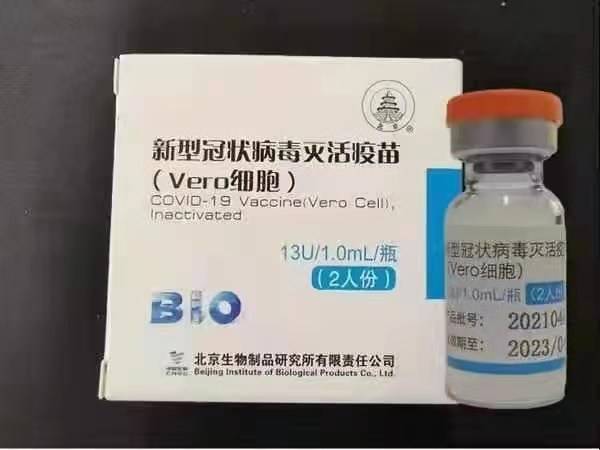
Sinopharm (Beijing): BBIBP-CorV
FASE 1
1 proef
ChiCTR2000032459
China
FASE 2
2 proeven
NCT04962906
Argentinië
ChiCTR2000032459
China
FASE 3
6 proeven
NCT04984408
ChiCTR2000034780
Verenigde Arabische Emiraten
NCT04612972
Peru
NCT04510207
Bahrein, Egypte, Jordanië, Verenigde Arabische Emiraten
NCT04560881, BIBP2020003AR
Argentinië
NCT04917523
Verenigde Arabische Emiraten
Goedkeuringen
WHO-lijst voor noodgebruik 59 landen
Angola, Argentinië, Bahrein, Bangladesh, Wit-Rusland, Belize, Bolivia, Brazilië, Brunei Darussalam, Cambodja, Kameroen, Tsjaad, China, Comoren, Egypte, Equatoriaal-Guinea, Gabon, Gambia, Georgië, Guyana, Hongarije, Hongarije 、Iran (Islamitische Republiek)、Irak、JordanKirgizië、Lao Democratische Volksrepubliek
Libanon, Maleisië, Maldiven, Mauritanië, Auritius, Mongolië, Montenegro, Marokko, Mozambique, Namibië, Nepal, Niger, Noord-Macedonië, Pakistan, Paraguay, Peru, Filipijnen, Republiek Congo, Enegal, Servië, Seychellen, Simonra Leone, Eilanden、Somalië、Sri Lanka、Thailand、Trinidad en Tobago、Tunesië、Verenigde Arabische Emiraten、Venezuela (Bolivariaanse Republiek)、Vietnam、Zimbabwe
Sinopharm BBIBP-CorV COVID-19 is een geïnactiveerd vaccin gemaakt van in kweek gekweekte virusdeeltjes die geen pathogeen vermogen hebben. Dit kandidaat-vaccin is ontwikkeld door Sinopharm Holdings en het Beijing Institute of Biological Products.
Het Sinopharm BBIBP-CorV-vaccin werkt doordat het immuunsysteem antilichamen kan produceren tegen het SARS-CoV-2 beta-coronavirus. Geïnactiveerde virusvaccins worden al tientallen jaren gebruikt, zoals het rabiësvaccin en het hepatitis A-vaccin. Deze ontwikkelingstechnologie is met succes toegepast op veel bekende vaccins, zoals het rabiësvaccin.
De SARS-CoV-2-stam van Sinopharm (WIV04-stam en bibliotheeknummer MN996528) werd geïsoleerd uit een patiënt in het Jinyintan-ziekenhuis in Wuhan, China. Het virus werd in kweek in een competente Vero-cellijn vermeerderd en het supernatant van geïnfecteerde cellen werd 48 uur geïnactiveerd met β-propiolacton (1:4000 vol/vol, 2 tot 8°C). Na opheldering van celresten en ultrafiltratie werd een tweede inactivatie van β-propiolacton uitgevoerd onder dezelfde omstandigheden als de eerste inactivatie. Volgens de WHO werd het vaccin geadsorbeerd op 0,5 mg aluin en geladen in voorgevulde spuiten in 0,5 ml steriele fosfaatgebufferde zoutoplossing zonder conserveermiddelen.
Op 31 december 2020 kondigde de State Drug Administration de goedkeuring aan van het experimentele vaccin ontwikkeld door Sinopharm.
Op 7 mei 2021 kondigde de Wereldgezondheidsorganisatie de goedkeuring van het vaccin aan. Dankzij de lijst met noodgevallen van de WHO konden landen hun eigen wettelijke goedkeuringen versnellen om het COVID-19-vaccin te importeren en toe te dienen. De WHO Advisory Expert Group on Immunization Strategies heeft ook haar beoordeling van het vaccin afgerond. Op basis van al het beschikbare bewijs beveelt de WHO twee doses vaccin aan, met een tussenpoos van drie tot vier weken, voor volwassenen van 18 jaar en ouder. De werkzaamheid van het vaccin tegen symptomatische en ziekenhuisopnames wordt geschat op 79% voor alle leeftijdsgroepen samen.
De American Medical Association publiceerde op 26 mei 2021 "A Randomized Clinical Trial: Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults" en concludeerde dat "in deze vooraf gespecificeerde tussentijdse analyse van een gerandomiseerde klinische studie, volwassenen De 2 geïnactiveerde SARS-CoV-2-vaccins die in deze vooraf gespecificeerde tussentijdse analyse van gerandomiseerde klinische onderzoeken werden toegediend, verminderden het risico op symptomatische COVID-19 aanzienlijk en ernstige bijwerkingen waren zeldzaam." In deze gerandomiseerde fase 3-studie bij volwassenen was de werkzaamheid van de 2 geïnactiveerde hele virusvaccins in symptomatische COVID-19-gevallen respectievelijk 72,8% en 78,1%. 2 vaccins hadden zeldzame ernstige bijwerkingen met een vergelijkbare frequentie als de controlegroep met alleen aluin, en de meeste waren niet gerelateerd aan vaccinatie. Een verkennende analyse wees uit dat de 2 vaccins meetbare neutraliserende antilichamen induceerden, vergelijkbaar met de resultaten van de fase 1/2-studie.
De WHO SAGE-werkgroep heeft op 10 mei 2021 een beoordeling van het Sinopharm/BBIBP COVID-19-vaccin gepubliceerd. oververhitting. Dientengevolge, schade, meldde GAVI op 14 mei 2021. slimme labels, vervaardigd door Zebra Technologies en gemaakt door Temptime Corporation, bestaan uit een cirkel met een lichter gekleurd vierkant in het midden, gemaakt van een kleurloze chemische stof die in de loop van de tijd onomkeerbaar kleur ontwikkelt . Dit wordt donkerder om een visuele indicatie te geven van cumulatieve blootstelling aan warmte. Zodra de injectieflacon is blootgesteld aan hitte buiten het optimale bewaarbereik, wordt het vierkant donkerder dan de cirkel, wat aangeeft dat het vaccin niet langer mag worden gebruikt.
National Drug BBIBP-CorV COVID-19 vaccin medicijnbibliotheek registratienummer: DB15807.